التوصية بالأجسام المضادة: الكيمياء المناعية TROP2-الكيمياء المناعية
 2024-06-20
2024-06-20
من قبل المشرف
 ما هو TROP2؟
ما هو TROP2؟
تعريف وهيكل TROP2
TROP2 (الكيمياء المناعية) هو بروتين عبر غشاء موجود على سطح خلايا الأرومة الغاذية البشرية والخلايا السرطانية.
يعد TROP2 هدفًا جزيئيًا شائعًا لعلاج السرطان، وقد تمت الموافقة على متقارنات الأجسام المضادة للأدوية (ADCs) التي تم تطويرها ضد TROP2 وتسويقها. على سبيل المثال، دواء تراستوزوماب ديروكستيكان هو دواء متقارن للأجسام المضادة يستخدم لعلاج المرضى المصابين بسرطان الثدي الثلاثي السلبية (TNBC).
في الاجتماع السنوي للجمعية الأمريكية لعلم الأورام السرطانية الأمريكية (ASCO) الذي اختتم مؤخرًا في عام 2023، أظهرت أدوية TROP2 ADC، داتوبوتاماب ديروكستيكان و SKB264، إمكانات علاجية عالية في علاجات الخط الأول والخط المتأخر لسرطان الرئة غير صغير الخلايا (NSCLC) (جلسة ASCO ADC | TROP2 ADC يضيء).
وفقًا للوائح الإدارة الخاصة باللجنة الوطنية للصحة، يجب أن تخضع الأدوية الموجهة المضادة للأورام ذات الأهداف المحددة لاختبار الهدف المقابل قبل الاستخدام. بالنسبة للأدوية التي تستهدف هدف TROP2، يمكن أن يوفر اختبار الكيمياء المناعية في قسم علم الأمراض إرشادات دقيقة للأدوية.
دور TROP2 في العمليات الخلوية
يشارك TROP2 في عمليات خلوية متنوعة مثل تكاثر الخلايا والهجرة والالتصاق. وهو يعمل من خلال التفاعل مع جزيئات سطح الخلية الأخرى، ويؤثر على المسارات التي تنظم دورة الخلية وموت الخلايا المبرمج. وقد ثبت أن TROP2 يعمل على تسهيل التواصل بين الخلايا والبيئة المحيطة بها، مما يجعله لاعبًا حاسمًا في الحفاظ على سلامة الخلايا ووظيفتها.
أهمية TROP2 في السرطان
فرط التعبير عن TROP2 في الأورام
وقد كشفت الأبحاث أن TROP2 كثيرًا ما يتم الإفراط في الإفصاح عن هذا المرض في أشكال مختلفة من السرطان، بما في ذلك سرطان الثدي والرئة وسرطان القولون والمستقيم. هذا الإفراط في التعبير يرتبط ارتباطًا وثيقًا بسلوك الورم العدواني وسوء التشخيص. تساهم المستويات المرتفعة من TROP2 في زيادة الانتشار الخلوي والورم الخبيث، مما يسلط الضوء على أهميته في تكوين الأورام.
آليات دور TROP2 في تطور السرطان
يسهل TROP2 تطور السرطان من خلال عدة آليات. فهو يعزز الانتقال الظهاري الوسيطي الظهاري (EMT)، مما يعزز القدرات الغازية للخلايا السرطانية. علاوة على ذلك، يعمل TROP2 على تنشيط مساري إشارات Akt و ERK، وهما أمران حاسمان لبقاء الخلايا وانتشارها. تُمكّن هذه الآليات مجتمعةً الأورام من النمو والانتشار بكفاءة أكبر، مما يؤكد إمكانات TROP2 كهدف علاجي.
القيمة التشخيصية والتنبؤية لـ TROP2
بروتين TROP2 والاختبارات المرضية
وقد أظهرت الدراسات أن TROP2 يتم الإفراط في إظهاره في العديد من الأورام الخبيثة، مثل سرطان عنق الرحم (89%)، وسرطان المسالك البولية (83%)، وسرطان الغدة الدرقية الحليمي (83%)، وسرطان الثدي (80%)، وسرطان الرئة ذو الخلايا الحرشفية (75%)، وسرطان بطانة الرحم (72%), وسرطان البروستاتا (71%)، وسرطان القولون (68%)، وسرطان الرئة الغدي (64%)، وسرطان المبيض الظهاري (59%)، وسرطان المعدة (56%)، وسرطان البنكرياس (55%)، ويرتبط بسوء التشخيص وزيادة خطر الإصابة بالنقائل.
تجدر الإشارة إلى أن العديد من الدراسات السريرية المتعلقة بالأدوية التي تستهدف TROP2 جارية حاليًا. اعتبارًا من يونيو 2023، هناك 33 تطويرًا عالميًا للأدوية التي تستهدف TROP2، و46 تقييمًا صينيًا للأدوية، و96 تجربة سريرية عالمية، و27 تجربة سريرية صينية تستهدف TROP2 (مصدر البيانات: PharmCloud).
المؤشرات الحيوية المحتملة في علم الأورام
الاكتشاف والتشخيص المبكر
يعمل TROP2 كمؤشر حيوي قيّم للكشف المبكر عن السرطان وتشخيصه. فمستويات تعبيره العالية في الأنسجة الخبيثة مقارنةً بالأنسجة الطبيعية تجعله مرشحاً ممتازاً لإجراء فحوصات تشخيصية. يمكن أن يساعد الكشف عن TROP2 في تحديد السرطان في مرحلة مبكرة، مما قد يحسن نتائج المرضى من خلال التدخل في الوقت المناسب.
القيمة التنبؤية لنتائج العلاج
كما يمكن لمستوى تعبير TROP2 التنبؤ باستجابات العلاج لدى مرضى السرطان. وقد أظهرت الدراسات أن الأورام التي تحتوي على مستويات عالية من TROP2 قد تستجيب بشكل مختلف لبعض العلاجات الكيميائية والعلاجات الموجهة. وبالتالي، فإن قياس مستوى تعبير TROP2 يمكن أن يساعد أطباء الأورام على تكييف خطط العلاج لتحقيق فعالية أفضل وتقليل الآثار الضارة.
الاستهداف العلاجي لـ TROP2
تطوير العلاجات التي تستهدف TROP2
الأجسام المضادة وحيدة النسيلة ضد TROP2
الأجسام المضادة أحادية النسيلة التي تستهدف TROP2 على وجه التحديد لمكافحة السرطانات التي تفرط في إفراز هذا البروتين. وترتبط هذه الأجسام المضادة بالمجال خارج الخلية لبروتين TROP2، مما يثبط وظيفته ويحفز التدمير المناعي للخلايا السرطانية بوساطة المناعة. وتجري حالياً تجارب سريرية لتقييم سلامتها وفعاليتها في أنواع مختلفة من السرطان.
الأجسام المضادة-الأدوية المترافقة (ADCs) التي تستهدف TROP2
تُعد مركبات اقتران الأجسام المضادة بالأدوية (ADCs) التي تستهدف TROP2 نهجًا علاجيًا واعدًا. تتكون مركبات ADCs من أجسام مضادة أحادية النسيلة مرتبطة بعقار سام للخلايا، مما يسمح بتوصيل الدواء إلى الخلايا السرطانية التي تعبر عن TROP2. وتقلل هذه الطريقة من الأضرار التي تلحق بالأنسجة الطبيعية مع القضاء على الخلايا السرطانية بفعالية.
التجارب السريرية والعلاجات الناشئة
تبحث العديد من التجارب السريرية في علاجات جديدة تستهدف TROP2. تشير النتائج المبكرة إلى أن هذه العلاجات يمكن أن تقلل من حجم الورم وتطيل فترة البقاء على قيد الحياة لدى المرضى الذين يعانون من سرطانات متقدمة. تهدف العلاجات الناشئة إلى تعزيز خصوصية وفعالية علاجات العلاجات التي تستهدف TROP2مما يوفر الأمل في تحسين إدارة السرطان في المستقبل.
الاتجاهات المستقبلية لأبحاث TROP2
التحديات والقيود المحتملة
مشكلات مقاومة العقاقير
ويتمثل أحد التحديات المحتملة في استهداف TROP2 في تطور مقاومة الأدوية. فقد تطور الأورام آليات للتهرب من التأثيرات العلاجية للعلاجات التي تستهدف TROP2. يتمثل الهدف الرئيسي للبحث في اكتشاف طرق المقاومة هذه والتوصل إلى علاجات مركبة يمكنها التغلب عليها.
الخصوصية والمخاوف المتعلقة بالسلامة
إن ضمان خصوصية وسلامة العلاجات التي تستهدف TROP2 أمر بالغ الأهمية. إذ يمكن أن تؤدي التأثيرات غير المستهدفة على الأنسجة السليمة إلى أحداث ضارة. يتم إجراء المزيد من الدراسات لتحسين هذه العلاجات بحيث تكون أكثر دقة في قتل الخلايا السرطانية مع تجنيب الخلايا السليمة. وهذا سيجعلها أكثر أماناً.
السبل الواعدة للدراسات المستقبلية
في المستقبل، قد يبحث الباحثون عن طرق جديدة لجعل الأدوية التي تستهدف TROP2 تعمل بشكل أفضل. قد تعمل هذه العلاجات بشكل أفضل عند استخدامها مع أنواع أخرى من العلاج، مثل العلاج المناعي أو الإشعاعي. سيساعد أيضًا العثور على علامات يمكن أن تتنبأ بمدى فعالية الأدوية التي تستهدف TROP2 في تخصيص العلاج لكل مريض.
تأثير فهم برنامج TROP2 على استراتيجيات علاج السرطان
لقد تغيرت العلاجات الاستهدافية كثيرًا منذ أن اكتشف العلماء الدور الذي يلعبه TROP2 في السرطان. فقد توصل الباحثون إلى طرق جديدة لعلاج السرطان أكثر دقة وفعالية من خلال الاستفادة من زيادته في الأورام. من المرجح أن تؤدي المزيد من الدراسات حول TROP2 إلى خطط علاجية أكثر تقدمًا، مما سيكون له تأثير كبير على مستقبل السرطان.
في 27 يونيو 2022, أسكو نشر دليلًا إرشاديًا محدثًا بشأن الواسمات البيولوجية للعلاج الجهازي لسرطان الثدي النقيلي في مجلة علم الأورام السريري. واستنادًا إلى الممارسة الحالية، غيرت التوصية كيفية العثور على العلامات الجزيئية لسرطان الثدي النقيلي. إحدى هذه العلامات هي التعبير عن TROP2.

في الوقت الحالي، يتم الكشف عن تعبير بروتين TROP2 بشكل أساسي باستخدام الكيمياء المناعية.
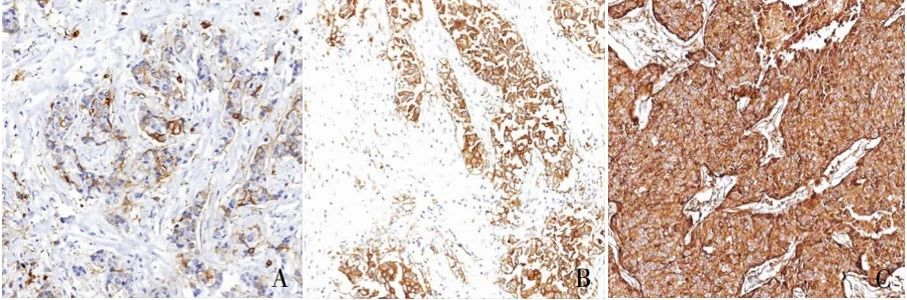
مثال للتلوين المناعي الكيميائي المناعي TROP2 باستخدام طريقة SP: أ. 1+، تلطيخ ضعيف في غشاء الخلية أو السيتوبلازم لخلايا الورم >10%؛ ب. 2+، تلطيخ معتدل في غشاء الخلية أو السيتوبلازم لخلايا الورم >10%؛ ج. 3+، تلطيخ قوي في غشاء الخلية أو السيتوبلازم لخلايا الورم >10%.
سيلنوفت بيوتكتأسست في عام 2010، وهي شركة ذات تقنية عالية متخصصة في البحث والتطوير والإنتاج والمبيعات لأدوات وكواشف التشخيص الدقيق للأورام. مع التركيز القوي على علم أمراض الأورام، أنشأت سيلنوفت نظاماً شاملاً يلتزم بمتطلبات ممارسات التصنيع الجيدة، بما في ذلك الإنتاج ومراقبة الجودة والبحث والتطوير.
تقدم سيلنوفت مجموعة شاملة من الكواشف الكيميائية الكيميائية الكيميائية المناعيةبما في ذلك تلك التي يمكن استخدامها للكشف عن بروتين TOP 2. وبفضل خبرتها في مجال أبحاث الكيمياء المناعية وتطويرها، توفر الشركة أكثر من 460 جسمًا مضادًا أوليًا، وأنظمة الكشف عن الأجسام المضادة الثانوية، وأكثر من 200 منتج لمراقبة جودة الكيمياء المناعية. منتجاتها مثل كاشف كروموجينيك المناعيو مجموعة أدوات الكشف عن البوليمر المعالج بالهرمونات المكبرة الدقيقة™ بلس جميعها حلولاً فعالة للكيمياء المناعية. تقدم Celnovte أيضًا منصات تلطيخ مؤتمتة بالكامل، مما يضمن نتائج تلطيخ عالية الجودة للعملاء. هذه الكواشف الكيميائية للكيمياء المناعية مصممة لدعم التطبيقات التشخيصية الدقيقة في مجال علم أمراض الأورام. ومن خلال التزامها بالجودة والابتكار والخدمة، تهدف "سيلنوفت" إلى أن تكون مزوداً رائداً لحلول الكيمياء المناعية الكيميائية لمنتجات تشخيص أمراض الأورام.
المنتجات ذات الصلة






